
患者の今・将来を考慮した生物学的製剤の早期導入の意義
~Type2炎症重症喘息治療を再考する~
重症喘息の管理目標と治療の安全性~将来のリスク回避の重要性~
檜澤(司会):本日は、重症喘息患者の現在と将来のリスクを考慮した治療のあり方をテーマとして議論させて頂きます。はじめに山田先生から『喘息予防・管理ガイドライン2018』に記された喘息の管理目標について解説して頂きます。
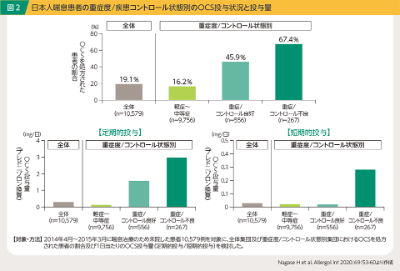
山田:ガイドラインでは喘息の2つの管理目標として「症状のコントロール」と「将来のリスク回避」が記載されています1)。症状のコントロールでは、気道炎症を制御し、正常な呼吸機能を保つことが目標とされ、将来のリスクとしては、呼吸機能の経年低下の抑制、喘息死の回避、副作用発現の回避が挙げられています(図1)。喘息治療において最も治療強度の高いステップ4では、高用量ICS/LABAに加えてLAMAやLTRAなどを併用しますが、それでもコントロール不良の場合、生物学的製剤やOCS、気管支熱形成術が治療選択肢となります。ただしOCSに関しては全身性の副作用に対する懸念があり、ガイドラインにおいても短期間の間欠的投与を原則とするとされていますので、こうした症例に対しては生物学的製剤の投与を積極的に検討すべきであると思います。一方国内の調査では、コントロール不良な重症患者の67.4%でOCSが投与されており、また短期的投与に限らず定期的な投与も行われていることが示されています2)(図2)。繰り返しになりますが、OCSは様々な全身性の副作用が報告されているほか3)、患者自身も長期的な影響や副作用に関して懸念を抱いていることが報告されており4)、こうした状況は打破していかなければならないと考えています。
檜澤:将来のリスクには治療薬の有害事象も含まれますので、OCSの使用を減らすことは重要なポイントとなりますね。木村先生に伺いますが、患者のコントロール状況を把握するために、症状以外にフォローすべき項目はありますか。
木村:私は、気道炎症の評価のため、2型炎症のバイオマーカーである血中好酸球数及び呼気一酸化窒素(FeNO)を定期的にフォローしています。また正常な呼吸機能を保つだけでなく、長期的な経年低下を抑制し将来のリスクを回避するという目的からも、定期的に呼吸機能検査を実施しています。将来のリスクという点では、山田先生と同様、OCSの減量が重要だと思いますので、生物学的製剤は非常に有用な選択肢だと思います。
檜澤:南先生が重症喘息の治療において留意されていることは何でしょうか。
南:すでにご指摘頂いたように、重症喘息の治療では増悪を抑制すると同時に、治療の安全性にも留意することが重要です。症状のコントロールに必要なステロイド使用量や増悪頻度の状況も鑑みつつ、現在では生物学的製剤も選択できますので、例えば増悪を年に2回以上などの頻度で繰り返している患者に対しては早めに生物学的製剤の情報を提供し、導入時期を一緒に考えるようにしています。
.png 400w, /.imaging/mte/sanofi-emr/img-w500/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_01--2-.png/jcr:content/fig_01%20(2).png 500w, /.imaging/mte/sanofi-emr/img-w600/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_01--2-.png/jcr:content/fig_01%20(2).png 600w, /.imaging/mte/sanofi-emr/img-w700/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_01--2-.png/jcr:content/fig_01%20(2).png 700w, /.imaging/mte/sanofi-emr/img-w800/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_01--2-.png/jcr:content/fig_01%20(2).png 800w, /.imaging/mte/sanofi-emr/img-w900/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_01--2-.png/jcr:content/fig_01%20(2).png 900w)
.png 400w, /.imaging/mte/sanofi-emr/img-w500/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_02--1-.png/jcr:content/fig_02%20(1).png 500w, /.imaging/mte/sanofi-emr/img-w600/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_02--1-.png/jcr:content/fig_02%20(1).png 600w, /.imaging/mte/sanofi-emr/img-w700/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_02--1-.png/jcr:content/fig_02%20(1).png 700w, /.imaging/mte/sanofi-emr/img-w800/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_02--1-.png/jcr:content/fig_02%20(1).png 800w, /.imaging/mte/sanofi-emr/img-w900/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_02--1-.png/jcr:content/fig_02%20(1).png 900w)
ステロイド抵抗性とデュピクセント治療の意義
檜澤:ステロイドを使用しているにもかかわらずコントロール不良の場合、ステロイド抵抗性の病態が考えられます。木村先生からは、喘息の病態機序の観点からステロイド抵抗性について解説して頂きます。
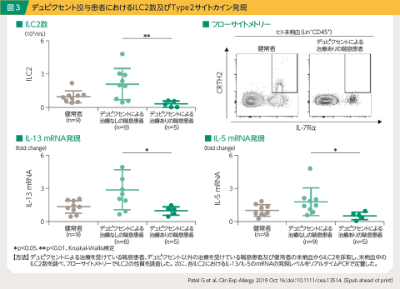
木村:喘息におけるType2炎症は、Th2細胞や2型自然リンパ球(ILC2)からIL-4、IL-5、IL-13が産生されることで引き起こされます。ステロイドはType2炎症に関与する炎症細胞の活性や細胞数を広く抑制する作用を持っていると考えられていますが、重症喘息の一部にはステロイド抵抗性を持つ症例が存在します1)。最近になって、このステロイド抵抗性の機序には、自然免疫系の中心を担うILC2が関与していることが明らかとなってきました。一定の条件下でILC2がステロイド抵抗性を獲得することが報告されています5)。一方、デュピクセントを投与した喘息患者と投与していない喘息患者で比較した報告では、デュピクセント投与喘息患者群でILC2数が有意に少なく、ILC2から産生されるType2サイトカインの遺伝子発現量も有意に低かったことが示されています6)(図3)。
檜澤:デュピクセントの臨床試験において、重症喘息患者のステロイド使用量への影響は示されているのでしょうか。
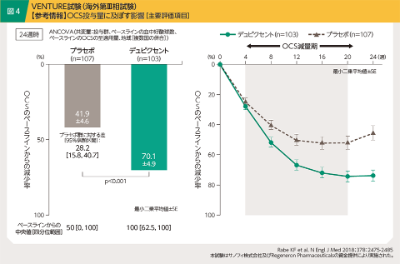
木村:ステロイド依存性の重症喘息を対象とした海外の第Ⅲ相試験 VENTURE試験7)において、OCS投与量に対する影響が示されています。対象患者のOCS投与歴は平均1.64~1.77年、1日投与量は平均10.75~11.75mgであり、デュピクセントもしくはプラセボを投与開始してから4~20週の期間に所定のスケジュールに従いOCSを減量しました。喘息コントロール維持下での24週後におけるOCS減少率(最小二乗平均値)はプラセボ群が41.9%、デュピクセント群が70.1%であり(図4)、また24週後にOCSが不要となった患者の割合はプラセボ群が29.2%、デュピクセント群が52.4%で[ロジスティック回帰モデル(共変量:投与群、ベースラインのOCS至適用量、地域[複数国の併合]、及びベースラインの血中好酸球数)、p=0.002]、いずれも有意差が認められました(副次評価項目;参考情報)。さらにOCS減量下での24週後の気管支拡張薬投与前FEV(1 最小二乗平均値)はデュピクセント群でベースラインからの変化量が+220mLであり、デュピクセントによる呼吸機能改善効果は、OCS減量下においても良好に保たれることが示されました。
.png 400w, /.imaging/mte/sanofi-emr/img-w500/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_03--1-.png/jcr:content/fig_03%20(1).png 500w, /.imaging/mte/sanofi-emr/img-w600/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_03--1-.png/jcr:content/fig_03%20(1).png 600w, /.imaging/mte/sanofi-emr/img-w700/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_03--1-.png/jcr:content/fig_03%20(1).png 700w, /.imaging/mte/sanofi-emr/img-w800/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_03--1-.png/jcr:content/fig_03%20(1).png 800w, /.imaging/mte/sanofi-emr/img-w900/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_03--1-.png/jcr:content/fig_03%20(1).png 900w)
.png 400w, /.imaging/mte/sanofi-emr/img-w500/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_04--1-.png/jcr:content/fig_04%20(1).png 500w, /.imaging/mte/sanofi-emr/img-w600/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_04--1-.png/jcr:content/fig_04%20(1).png 600w, /.imaging/mte/sanofi-emr/img-w700/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_04--1-.png/jcr:content/fig_04%20(1).png 700w, /.imaging/mte/sanofi-emr/img-w800/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_04--1-.png/jcr:content/fig_04%20(1).png 800w, /.imaging/mte/sanofi-emr/img-w900/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_04--1-.png/jcr:content/fig_04%20(1).png 900w)
IL-4/IL-13の気道構成細胞に対する影響とデュピクセント治療の意義
檜澤:次に、南先生から、Type2炎症におけるIL-4/IL-13の役割についてご解説頂きます。
南:まずIL-4/IL-13は、種々の免疫細胞に作用することが知られています。喘息病態では、IgEがマスト細胞や好塩基球からの脱顆粒を誘導しアレルギー反応を惹起していますが、IL-4/IL-13はB細胞のIgE産生細胞へのクラススイッチに関与し、IgE産生を誘導することが報告されています。また好酸球が気道炎症を引き起こすまでの分化増殖・組織遊走・活性化の3ステップのうち、IL-4/IL-13はVCAM-1やエオタキシン、GM-CSF、ペリオスチンなどを介して組織遊走及び活性化に関与することが報告されています。
さらにIL-4/IL-13は、気道構成細胞にも直接的な影響を与えます。IL-13は気道上皮において杯細胞の過形成及び粘液の過剰産生を引き起こします。In vitroの検討では、IL-13の添加により、気道上皮細胞からのムチンMUC5AC産生が促進されたことが報告されています8)。このIL-13によるMUC5AC産生誘導はステロイドを添加しても抑制されませんでしたが、BALB/cマウスを用いた別の研究では、チリダニ曝露によって誘導された杯細胞過形成及びMUC5AC遺伝子の発現上昇が、IL-4/IL-13のシグナル伝達を阻害する抗IL-4Rαモノクローナル抗体によって抑制されたことが報告されています9)。
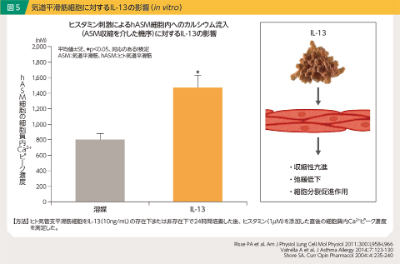
また、IL-13は気道平滑筋細胞に対しても直接的な作用を示します。In vitroの検討では、IL-13の添加により、ヒスタミン刺激による気道平滑筋細胞内へのカルシウム流入量が増加したことが示されており10)(図5)、IL-13は気道平滑筋の収縮性亢進や弛緩低下を誘導していると考えられます。
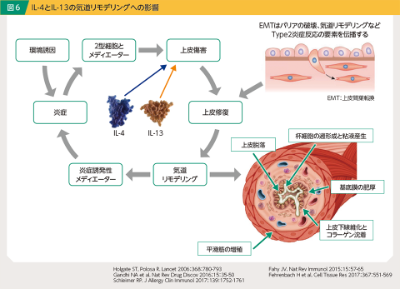
これらの知見以外にも、IL-4/IL-13は上皮バリアの破綻に関与し11, 12)、IL-13は気道組織の線維化に関与するなど13, 14)様々な作用が明らかにされています。総括すると、IL-4/IL-13は気道の炎症反応や気道過敏性を亢進させるだけでなく、平滑筋の増殖、杯細胞過形成や粘液産生、基底膜の肥厚などを介した気道リモデリングを亢進させることで、気流閉塞をさらに亢進させ、喘息患者の重症化の一因となっていると考えられます(図6)。
檜澤:IL-4/IL-13のシグナルを抑制するデュピクセントは、こうした様々な作用を阻害できる治療と言えますね。
南:おっしゃる通りです。免疫細胞の作用のほか、粘液産生や杯細胞過形成、平滑筋細胞の収縮性亢進と増殖、気道上皮のバリア機能破綻、上皮下の線維化などを広く抑制できることがデュピクセント治療の特徴の一つと言えます。
.png 400w, /.imaging/mte/sanofi-emr/img-w500/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_05--1-.png/jcr:content/fig_05%20(1).png 500w, /.imaging/mte/sanofi-emr/img-w600/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_05--1-.png/jcr:content/fig_05%20(1).png 600w, /.imaging/mte/sanofi-emr/img-w700/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_05--1-.png/jcr:content/fig_05%20(1).png 700w, /.imaging/mte/sanofi-emr/img-w800/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_05--1-.png/jcr:content/fig_05%20(1).png 800w, /.imaging/mte/sanofi-emr/img-w900/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_05--1-.png/jcr:content/fig_05%20(1).png 900w)
.png 400w, /.imaging/mte/sanofi-emr/img-w500/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_06--1-.png/jcr:content/fig_06%20(1).png 500w, /.imaging/mte/sanofi-emr/img-w600/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_06--1-.png/jcr:content/fig_06%20(1).png 600w, /.imaging/mte/sanofi-emr/img-w700/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_06--1-.png/jcr:content/fig_06%20(1).png 700w, /.imaging/mte/sanofi-emr/img-w800/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_06--1-.png/jcr:content/fig_06%20(1).png 800w, /.imaging/mte/sanofi-emr/img-w900/dam/emr-jp/products/dupixent_2/product_info/expertmeeting/20210519/fig_06--1-.png/jcr:content/fig_06%20(1).png 900w)
デュピクセント治療が適する患者像
檜澤:IL-4/IL-13のシグナルを抑制するベネフィットを考えた場合、デュピクセント治療はどのような患者に適していると言えるでしょうか。先生方のご意見を伺います。
山田:デュピクセントは単に炎症を抑えるだけではなく、リモデリング、気道過敏性に対する効果も期待できるので、病態の根本的な解決にもつながるのではないかと期待しています。またIgE産生細胞へのクラススイッチを抑制しますので、IgE高値の症例にも効果が期待できると考えています。
木村:Type2炎症のマーカーである好酸球やFeNOが高値である症例が基本的に良い適応になると考えられます。好酸球に関しても、IL-4/IL-13は組織遊走・活性化に関与しますので、好酸球性炎症の強い症例に対しても効果が期待されます。また気道構成細胞に対する作用を示す基礎データが多数ありますので、呼吸機能が経年低下してくるような症例や、喀痰の多い症例に対して効果が期待できると思います。さらにILC2に対する作用も示唆されていますので、ステロイド抵抗性のあるような症例にも、積極的な使用を検討しています。
南:私も気道構成細胞に直接作用できるという点が、デュピクセントの大きな特徴だと思います。加えて、好酸球性副鼻腔炎の合併例など、上気道においてもType2炎症が関与する病変が存在する症例にもデュピクセントを積極的に考慮すべきであると思います。
生物学的製剤の導入のタイミングとICについて
檜澤:最後は、生物学的製剤の導入に際してのICについて議論させて頂きます。どのようなタイミングで患者に生物学的製剤の導入を勧めるか、治療費についてどう説明なさるか先生方の方針をお聞かせ下さい。
山田:高用量のICS/LABAを投与しているのにもかかわらず症状が安定せずOCSを必要とする状況や、増悪を頻回に起こしている状況ですと導入を考慮します。いずれ生物学的製剤が必要になると考えられる患者に対しては早めに紹介をしておき、予定外受診や入院が起きた場合に、その後しばらくしてから「以前お話しした生物学的製剤の導入が必要でしょう」と切り出すと納得して頂けることが多いです。治療費に関しては、利用可能な医療費助成制度や保険ごとに異なる条件の全てを医師が情報収集し把握するのは困難ですので、ソーシャルワーカーと連携して説明対応してもらうようにしています。
南:私も比較的症状が安定している時期から生物学的製剤の話をするようにしています。経験上、2回、3回と繰り返し根気強く説明していくことも大切です。治療費や医療費助成制度については院内の会計課で詳しく説明していますが、デュピクセントには患者が利用できるコールセンター(デュピクセント相談室0120-50-4970)も設置されていますので案内しています。
木村:私もできるだけ早いタイミングで治療選択肢として生物学的製剤を提示するようにしています。最初から治療費の話をすると拒否的な反応になることが多いので、最初はまず効果を中心に、2回目以降から副作用や治療費について説明するようにしています。
まとめ:重症喘息の治療戦略においてデュピクセントが果たしうる役割
檜澤:本日の議論を振り返りまして、重症喘息の治療においてデュピクセントはどのような役割を持つのかコメントを頂きます。
南:デュピクセントが他の生物学的製剤と異なっている点は、炎症に関与する免疫細胞のみならず気道構成細胞にも作用することであると思います。それにより気道過敏性やリモデリング抑制が期待できることが大きな特徴であると考えています。
山田:私も同様の考えです。呼吸機能の経年低下を抑止できる可能性を考えると、とくに若い患者に対しては、早めに紹介して積極的に導入すべきであると思います。
木村:デュピクセントの作用機序から、治療に難渋しステロイド抵抗性であると考えられるケースにも、積極的に検討したいと思っています。
檜澤:本日の議論から、症状コントロールが不良な重症喘息患者においては現在の症状コントロールのみならず将来のリスクを抑制する目標を鑑みて、デュピクセントの早期導入に意義があることが確認されました。皆様、ありがとうございました。
[文献]
1)日本アレルギー学会:喘息予防・管理ガイドライン2018, 協和企画, 2018
2)Nagase H et al. Allergol Int 2020;69:53-60
3)Sullivan PW et al. J Allergy Clin Immunol 2018;141:110-116
4)Cooper V et al. NPJ Prim Care Respir Med 2015;25:15026
5)Kabata H et al. Commun 2013;4:2675
6)Patel G et al. Exp Allergy 2020;50:267-270
7)Rabe KF et al. Engl J Med 2018;378:2475-2485[本試験はサノフィ株式
会社及びRegeneron Pharmaceuticalsの資金提供により実施された。]
8)Kanoh S et al. Clin Exp Allergy 2011;41:1747-1756
9)Hirota JA et al. Clin Exp Allergy 2010;40:820-830
10)Risse PA et al. Am J Physiol Lung Cell Mol Physiol 2011;300:
L958-L966
11)Saatian B et al. Tissue Barriers 2013;1:e24333
12)Sugita K et al. J Allergy Clin Immunol 2018;141:300-310
13)Lee CG et al. Exp Med 2001;194:809-821
14)Kavirante M et al. J Immunol 2004;173:4020-4029
e-MR医療関係者向け製品情報サイト
メディカル情報
領域情報
製品基本情報
各種設定/ヘルプ